Ковалентна химична връзка
СТРОЕЖ НА ВЕЩЕСТВОТО
В този урок ще научите:
- каква е същността на ковалентната връзка;
- какви видове ковалентни връзки има.
Каква е същността на ковалентната връзка?
Атомите на химичните елементи може да се свързват и чрез образуване на обща електронна двойка.
Обща електронна двойка се формира от единични електрони с противоположни спинове на свързващите се атоми.
В новообразуваната частица (молекула) тя принадлежи едновременно на двата атома и най-често се намира в пространството между двете ядра (фиг. 1).
Такъв тип свързване е характерен при взаимодействие на два или повече атома на неметали и се нарича ковалентна връзка.
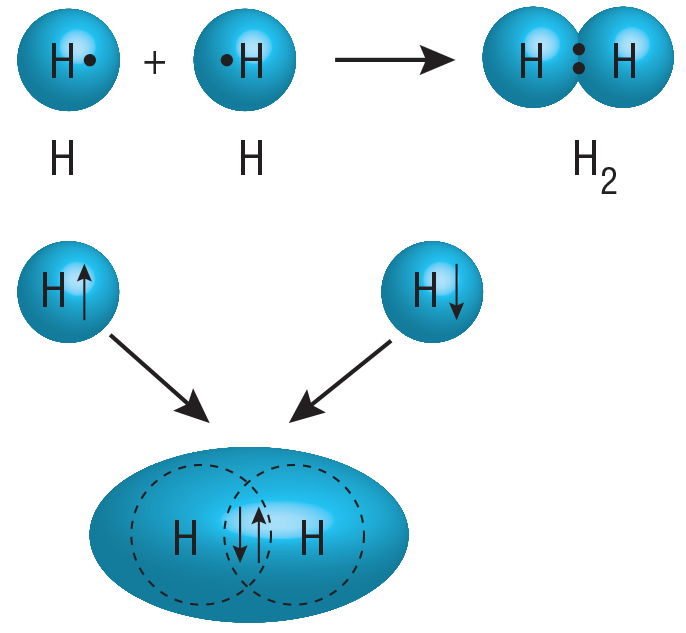
Фиг. 1. Модели на образуване на молекула водород чрез създаване на обща електронна двойка
Важно!
Ковалентната химична връзка се осъществява чрез обща електронна двойка. Тя се намира най-често между ядрата на атомите.
Прието е общата електронна двойка да се означава с две точки, разположени между химичните знаци на свързаните атоми.
H∙ + ∙H → H:H + 432 kJ
Формулите, в които свързването на атомите е изразено с общи електронни двойки, се наричат люисови формули (електронни формули). На една обща електронна двойка в люисова формула съответства една валентна черта от структурните формули на молекулите.
H : H H – H
люисова формула структурна формула


Между два атома може да се създаде повече от една обща електронна двойка. Например в молекулата на азота ковалентната връзка се осъществява от три общи електронни двойки

Един атом може да образува общи електронни двойки с повече от един атом. Например в молекулата на водата кислородният атом образува две общи електронни двойки – по една с всеки водороден атом.
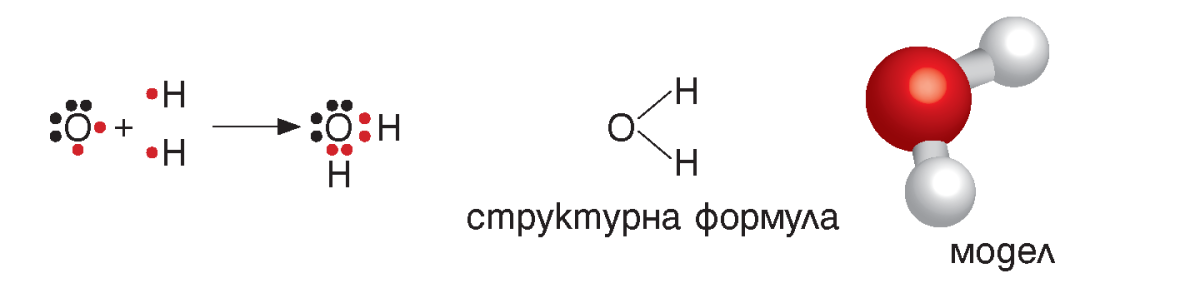
Важно!
• Ковалентната химична връзка се осъществява чрез общи електронни двойки, които принадлежат и на двата атома. • Валентността на елементите при ковалентната връзка се определя от броя на единичните електрони, с които всеки атом участва в образуването на общи електронни двойки. • Основната причина за образуването на химични връзки е намаляването на общата енергия на атомите при свързването им в молекули.
Какви видове ковалентни връзки има?
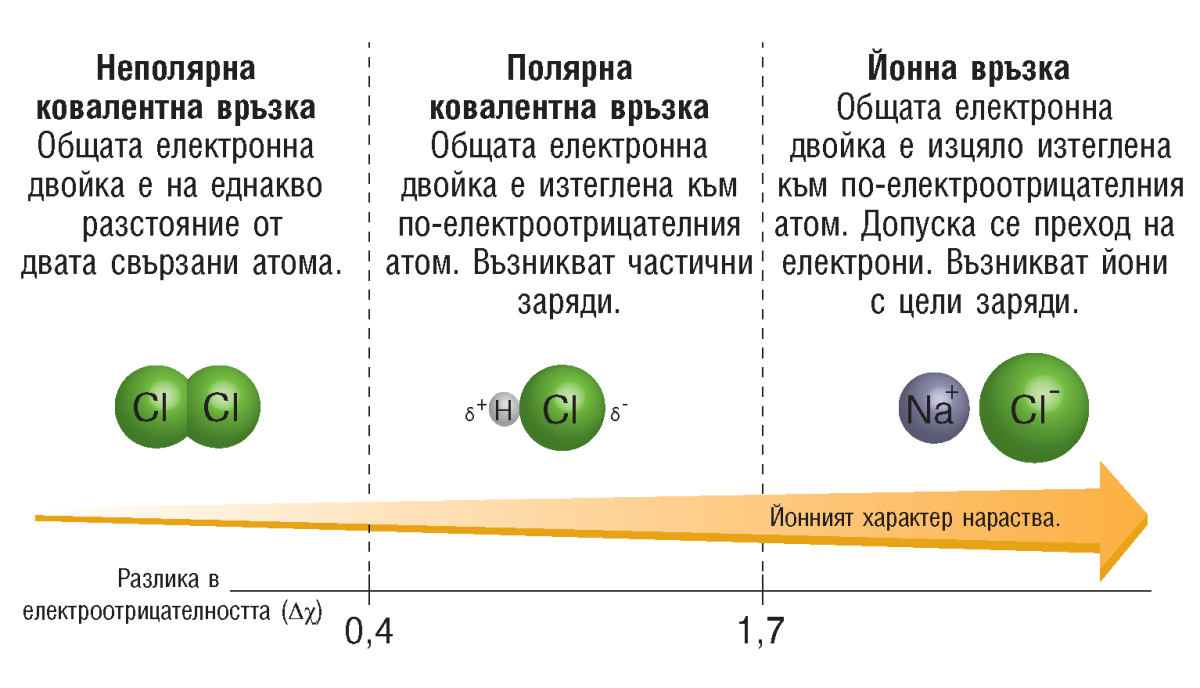
Ковалентната връзка може да е полярна или неполярна и това зависи от атомите, между които се осъществява. Ако тези атоми са еднакви по вид, общата електронна двойка принадлежи в еднаква степен и на двата атома.
Такава връзка е неполярна. Неполярни са връзките в молекулите на: азота (N2), водорода (Н2), хлора (Cl2), кислорода (О2).
Когато се свързват атоми на различни неметали, се образува полярна връзка. Такива са връзките в молекулите на хлороводорода и на водата. При полярната връзка електронната двойка принадлежи в по-голяма степен на единия от двата свързани атома.
Това се определя от едно важно свойство на атомите, наречено електроотрицателност.
Важно!
Свойството на атомите в химичните съединения да привличат към себе си общите електронни двойки, се нарича електроотрицателност. Електроотрицателността се бележи с гръцката буква χ (чете се „хи“).
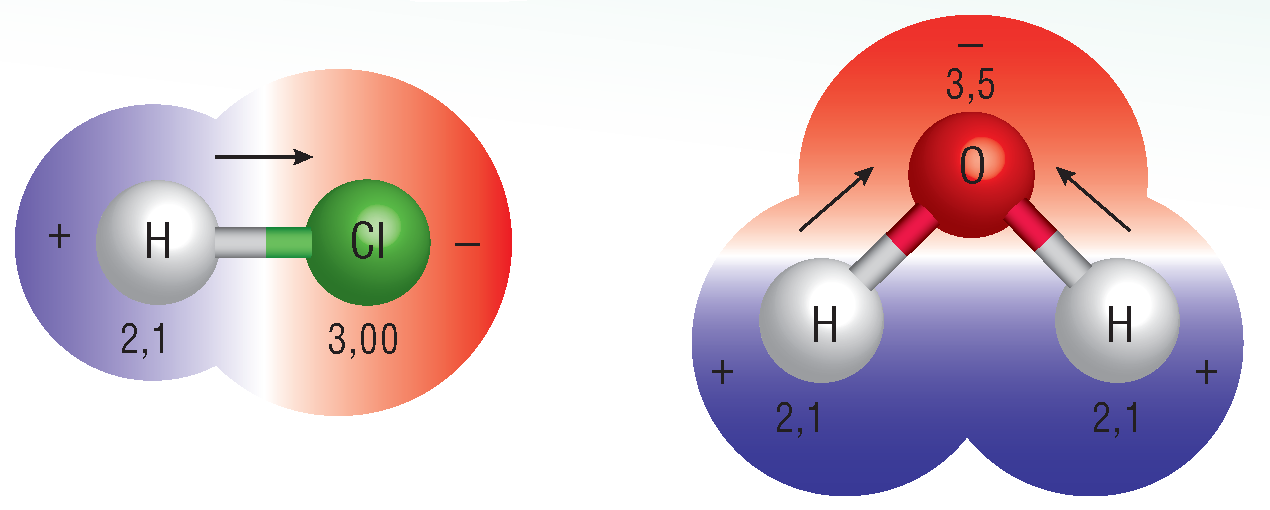
на химичната връзка
Кратност на ковалентната химична връзка
Според броя на общите електронни двойки между двата атома може да се образуват два вида ковалентни връзки:
- проста връзка – образувана е от една обща електронна двойка. Връзката е проста, или единична. Такива са връзките в халогенните молекули, в молекулите на водорода, хлороводорода, водата, амоняка и др.;
- сложна (кратна) връзка – образувана е от две или три общи електронни двойки, затова сложната връзка може да е двойна или тройна. В двойната връзка едната е по-здрава от другата, а при тройната едната е по-здрава от другите две. Сложни са връзките в молекулите на азота, кислорода, въглеродния диоксид и др.
Запомнете!
• Ковалентната връзка се осъществява чрез образуване на обща(и) и за двата атома електронна(и) двойка(и). • При свързване на атомите на химичните елементи с ковалентни връзки се получават молекули. • Основната причина за образуването на химични връзки е намаляването на енергията на атомите при свързването им в молекули. • Строежът на молекулите може да се изразява със структурни и с люисови формули. • Ковалентните връзки са полярни или неполярни, прости, двойни или тройни.