ВЪГЛЕРОД И НЕГОВИ НЕОРГАНИЧНИ СЪЕДИНЕНИЯ
Въглерод и неговият кръговрат
В този урок ще научите:
- какво е мястото на въглерода в периодичната таблица и какъв е строежът на атома;
- какви физични свойства притежава въглеродът;
- какви химични свойства са характерни за въглерода;
- какво е приложението на въглерода.
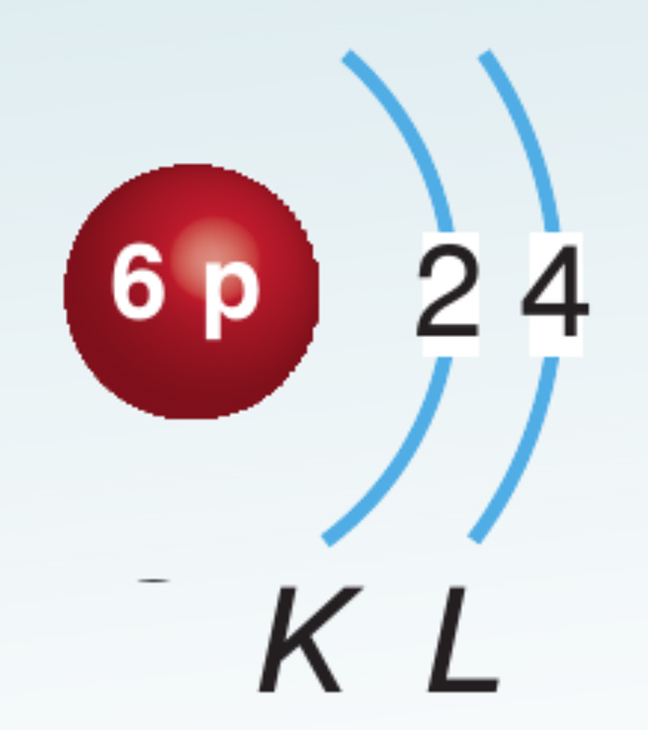
1. Какво е мястото на въглерода в периодичната таблица и какъв е строежът на атома?

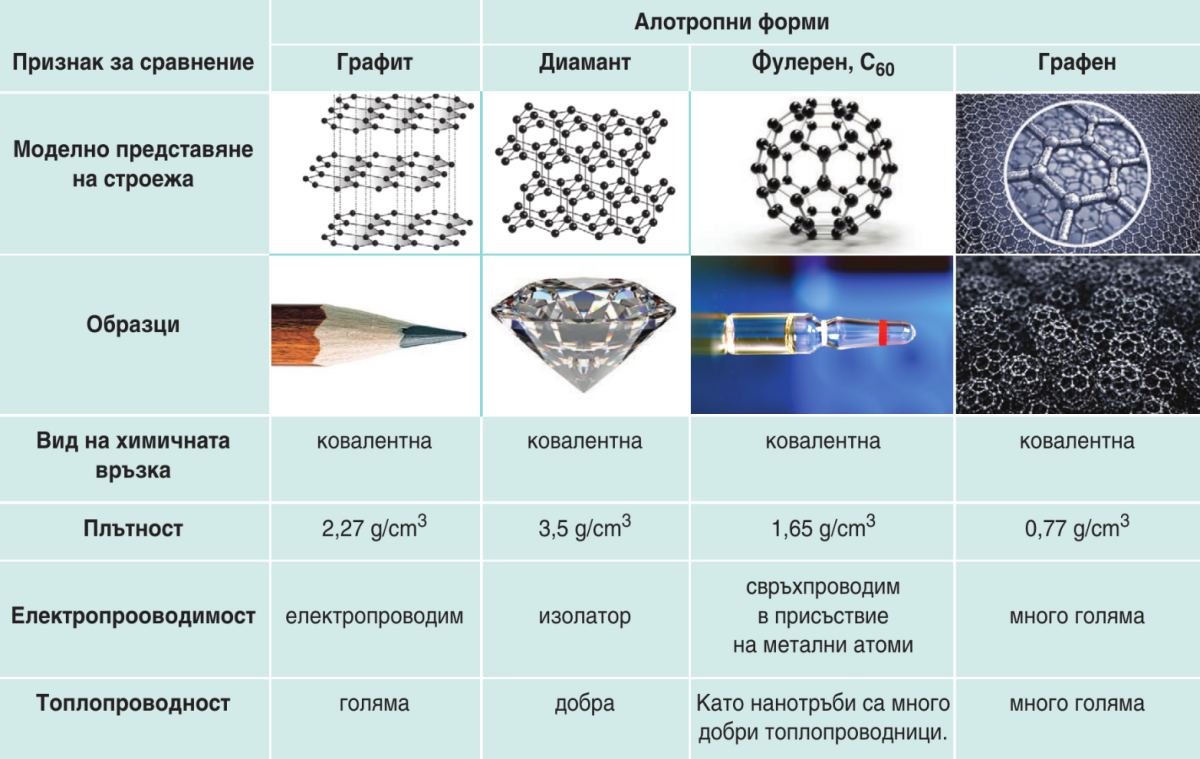
2. Какви физични свойства притежава въглеродът?
Таблица 1. Строеж и физични свойства на някои от простите вещества на въглерода
3. Какви химични свойства са характерни за въглерода?
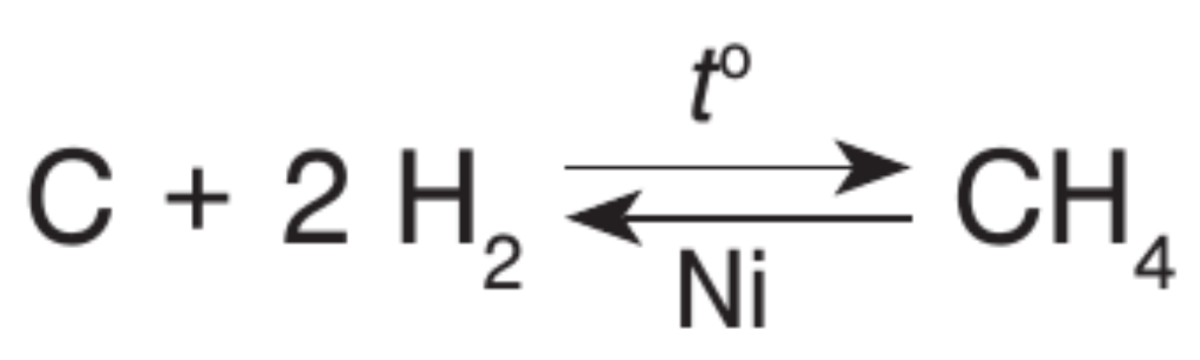
● Взаимодействие с водород
● Взаимодействие с кислорода
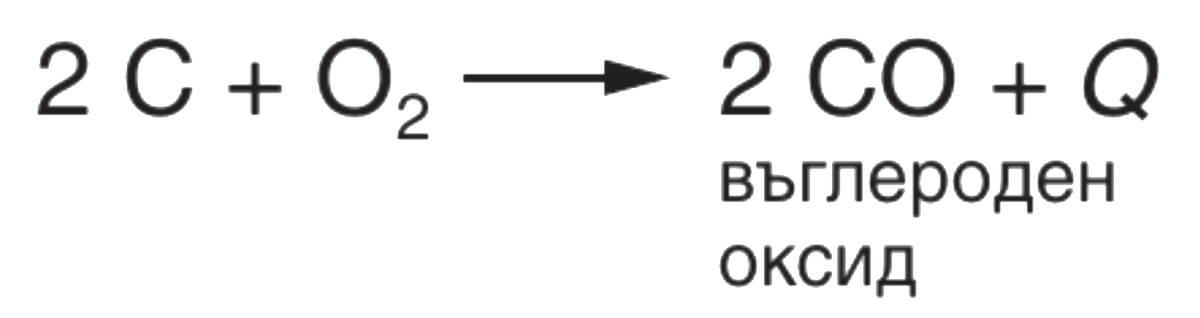
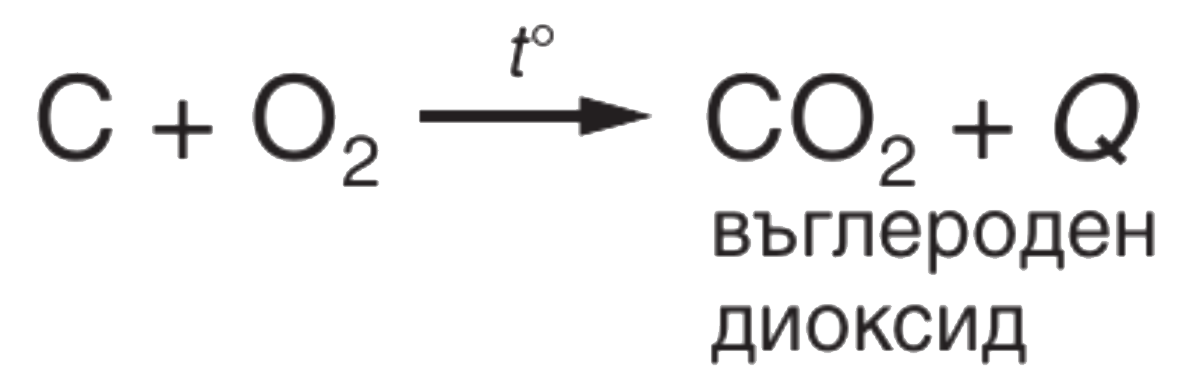

Важно!
Окисление е реакция, при която веществата взаимодействат и се свързват с кислорода. Кислородът е окислител.
● Взаимодействие с неметали
При стайна температура въглеродът взаимодейства единствено с флуора – получава се CF4. С хлора, сярата, силиция и др. взаимодейства при висока температура.
● Взаимодействие с метали
Въглеродът взаимодейства с активни метали при висока температура, като се получават солеобразни карбиди – Al4C3, CaC2, Na2C2 и др.
● Взаимодействие с метални оксиди
При висока температура въглеродът взаимодейства с метални оксиди, като се свързва с кислорода и се получават метал и въглероден оксид.

Важно!
Редукция е реакция, при която се отнема кислород от даден оксид. Веществото, което отнема кислорода, се нарича редуктор.
Под формата на кокс въглеродът се използва в металургията за редуциране на металните оксиди и получаване на метали. Въглеродът е добър редуктор.
● Взаимодействие с вода
Въглеродът взаимодейства с водни пàри при нагряване.

При продухване на нагрята водна пара през слой от накалени въглища в газгенератор се получава т.нар. воден газ (смес от въглероден оксид и водород). Този газ е висококалоричен, тъй като съдържа две газови горива – водород и въглероден оксид. Водният газ се използва не само като енергиен източник, но и като суровина за синтез на ценни съединения.
4. Какво е приложението на въглерода?
Запомнете!
• Въглеродът съществува в няколко алотропни форми, най-важни от които са диамантът и графитът. • Въглеродът се окислява при нагряване на въздуха, при което се получава въглероден оксид или въглероден диоксид. • Въглеродът взаимодейства с метални оксиди, при което се получават въглероден оксид и метал. • При взаимодействие с метални оксиди въглеродът се окислява, а металът се редуцира. • С вода при висока температура въглеродът образува въглероден диоксид и водород – воден газ. • При взаимодействие на въглерод с водород в присъствие на катализатор се получава метан. • Въглеродът е важен за живите организми елемент. Наричат го „елемент на живота“.